17 Best Das Periodensystem images

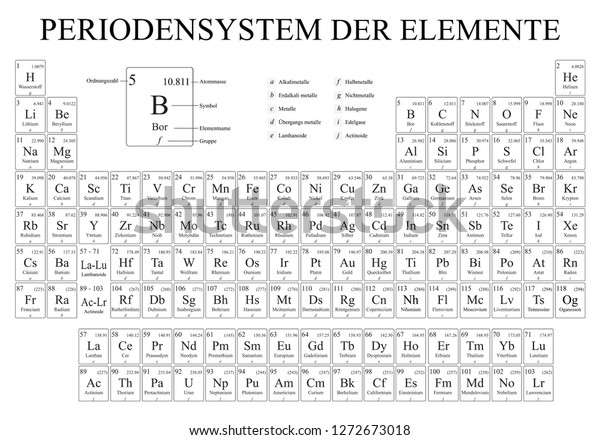
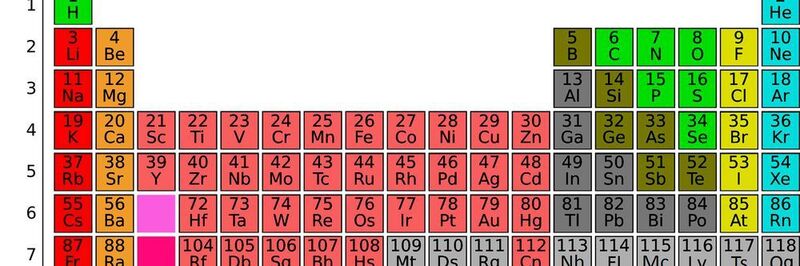
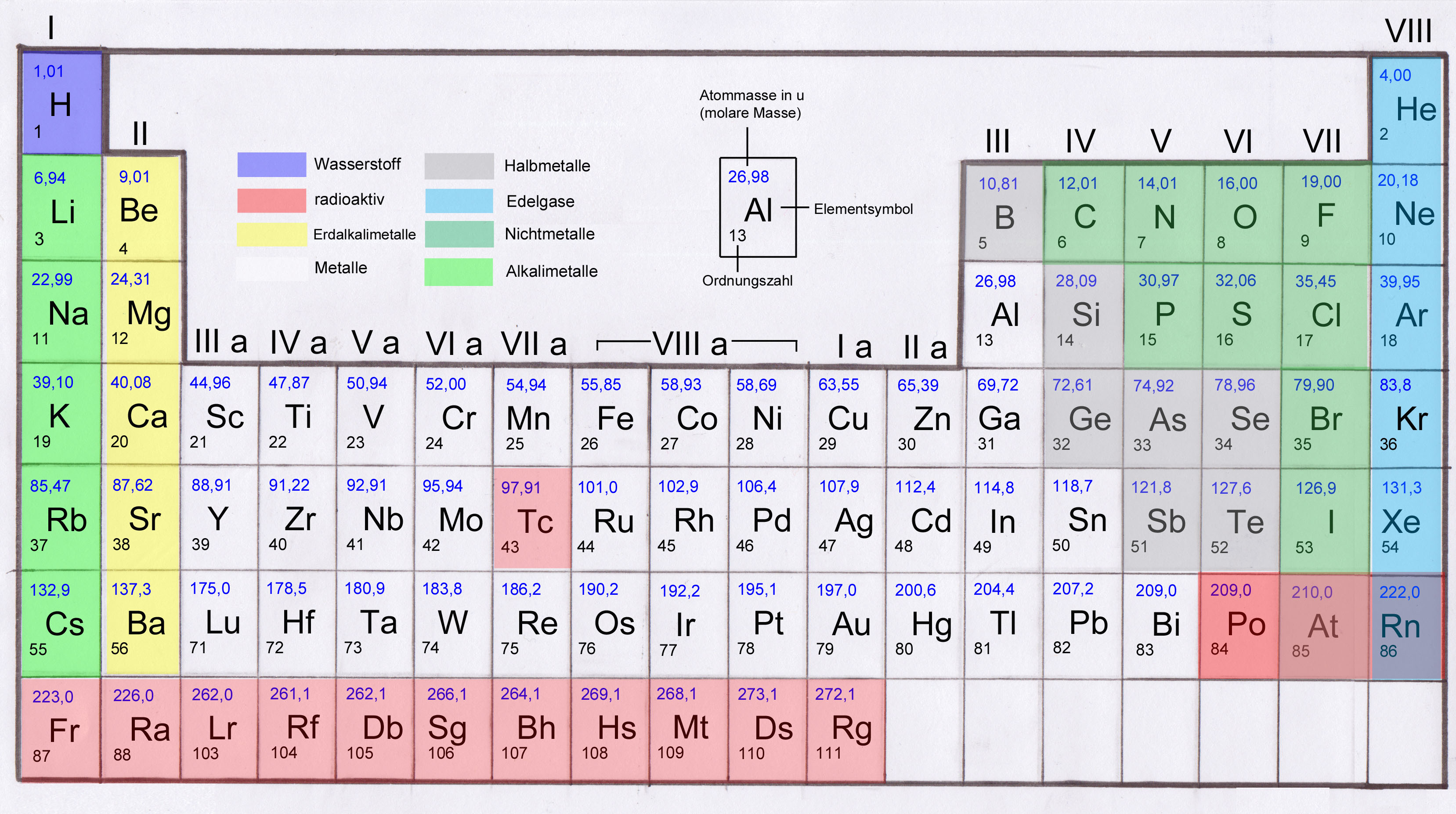
Kategorisierungen von Nichtmetallen Reaktive Nichtmetalle Edelgase H, C, N, P, O, S, Se, F, Cl, Br, I He, Ne, Ar, Kr, Xe, Rn Nichtmetalle Halogene Edelgase H, C, N, P, O, S, Se F, Cl, Br, I, At He, Ne, Ar, Kr, Xe, Rn Fest Flüssig Gasförmig C, P, S, Se, I, At Br H, N, O, F, Cl, He, Ne, Ar, Kr, Xe, Rn Elektronegative Nichtmetalle Stark elektronegative Nichtmetalle Edelgase H, C, P, S, Se, I N, O, F, Cl, Br He, Ne, Ar, Kr, Xe, Rn Mehratomige Elemente Zweiatomige Elemente Einatomige Elemente Edelgase C, P, S, Se H, N, O, F, Cl, Br, I He, Ne, Ar, Kr, Xe, Rn In den ersten Hauptgruppen des Periodensystems befinden sich die , gefolgt von den bis hin zu den. Man spricht bei diesen Atomarten von auf ein bestimmtes Element bezogen oder allgemeiner von verschiedenen. Da die Anzahl der Elektronen in der äußersten Schale, der sogenannten Valenzelektronen, die Eigenschaften der Elemente wesentlich beeinflussen, haben die Elemente einer Gruppe auch ähnliche Eigenschaften. Wie viele schöne Geschichten stimmt auch diese wahrscheinlich nicht. Die Kernladungszahl, auch Ordnungszahl genannt, definiert die Anzahl der Protonen, der positiv geladenen Teilchen in einem Atom. März 1869 stellte Mendelejew sein System auf einem Kongress der Russischen Chemischen Gesellschaft vor.