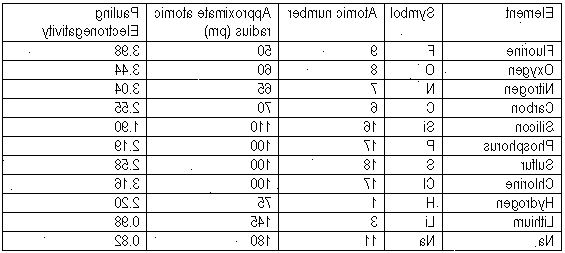
Elektronegativitet tabell. Elektrokemiska spänningsserien 2020-01-05
Uran
Kobberionene blir redusert og blir til kobber i metallform, samtidig som sink blir oksidert og blir til ioner. Den starka negativa kraft som så uppstår mellan atomkärnorna gör att bindningen mellan atomerna stärks och den kovalenta bindningen är verkligen mycket stark: För att befria 1% av väteatomerna i ett grundämne av vätemolekyler krävs en upphettning till 2 000 oC. Varje kolatom i diamant utgör en del av fem sådan tetraederstrukturer. När en kovalent bindning uppstår delar atomerna på två elektroner men inga elektroner tillförs eller tas bort från någon atom. ÜÇ En väteatom består ju av en proton och en elektron. När två ickemetaller reagerar med varandra, t.
Next
Naturfagblogg : Enkle redoksreaksjoner
Vid korrosionsberäkningar får man riktigare resultat om man gör testerna med saltvatten som. Orsaken till att atomer omvandlas till joner är deras strävan att efterlikna de mycket stabila ädelgaserna. Elektronerna förskjuts mot den starkt elektronegativa atomen i X-H bindningen H är beteckningen för väte. Vattenmolekylen består av en centralt placerad, negativt laddad syreatom flankerad av två positivt laddade väteatomer. Koldioxid är alltså inte någon dipol. Detta är typiskt för alla jonföreningar: De leder ström i smält och i upplöst form men inte i fast form.
Next
4 Atomer joner elektrokemi
Detta gör att laddningarnas polaritet upphäver varandra. Om skillnaden är mer än 2,1 är det en jonbindning och om skillnaden är mindre än 1,7 är det en polär kovalent bindning. Men som vi ska se finns också krafter som verkar mellan de kemiska bindningarna och påverkar deras egenskaper. I praktiken fungerar zink som offeranod gentemot aluminium, vilket man kan se i salttabellen nedan. Sølvet i ioner blir til sølv i metallform. När molekylerna består av fler än två atomer av olika slag avgör deras geometriska form om de blir dipoler eller inte.
Next
4 Atomer joner elektrokemi

På så vis bildar fem kolatomer en tetraederstruktur. Koldioxidmolekylen se bild nedan består av en centralt placerad, positivt laddad kolatom som omges av två negativt laddade syreatomer. De avgir ikke elektronene så lett som metallene til venstre for hydrogen i rekka. De vandrar fritt mellan alla de positivt laddade atomerna och binder alltså alla metalljoner till varandra lika mycket. Denna stabilitet gör att den kovalenta bindningen innehåller mindre energi än de två separata väteatomerna. De som är oädla bildar gärna medan de som är ädla ogärna bildar joner. De elektroner som inte tillhör någon av metallatomerna bildar ett gemensamt elektronmoln för hela metallkristallen.
Next
Alkylhalider

I det andre gjorde vi det bare den ene veien kobber i sølv, men ikke sølv i kobber. Ei vanleg inneheld ei eller fleire subkritiske mengder uran som under detonasjonen vert samanføydd til ei d. Tillsammans bildar alltså fyra kolatomer trianglar som i sin tur bildar regelbundna sexhörningar. Denna typ av bindning är typisk för metallerna och kallas därför metallbindning. Ädelgaserna har fullt med elektroner i sina yttersta elektronskal och det är detta som alla andra grundämnen eftersträvar. Elektroner kan alltså röra sig fritt kring dessa plan varför grafit leder elektricitet mycket bra.
Next
Naturfagblogg : Enkle redoksreaksjoner

Kobber er altså edlere enn sink, og er dermed lenger til høyre på spenningsrekken enn sink. Metode: Forsøk 1: Vi fant fram alt utstyret vi trengte. De fria elektronerna fungerar som svagt bindande krafter mellan planen varför grafit, till skillnad från diamant, är lätt att dela. Andra grundämnen bildar molekyler med fler än två atomer. Altså blir kobberet oksidert og sølvet redusert. Utarma uran blir brukt i.
Next
4 Atomer joner elektrokemi

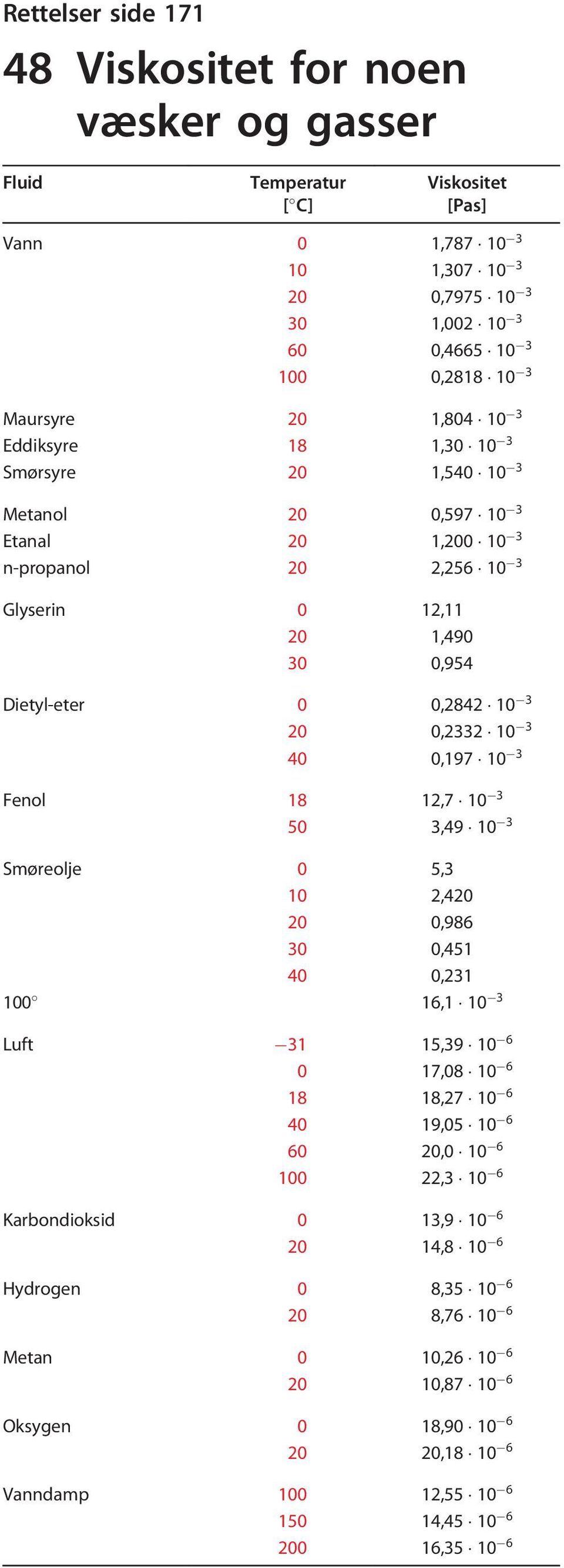
Jonföreningarna börjar bilda regelbundna mönster där jonernas yttersta elektronskal tangerar varandra. En molekyl består alltid av minst två atomer av olika eller likadana atomer. Balansen mellan de positivt laddade protonerna i atomkärnorna och elektronerna gör däremot att bindningen mellan vätemolekylerna inte blir särskilt stark. Som man kan se verkar det som om skulle agera som gentemot enligt vätetabellen. De två väteatomerna delar allstå på sina två gemensamma elektroner vilket gör att deras yttersta elektronskal får samma antal elektroner som ädelgasen helium. Varmen som oppstår ved av uran blir overført til eit kjølemedium vatn, eller smelta , som enten kan brukast direkte til å lage damp kokevatnsreaktor eller til å varme opp sekundært kjølevatn. Sink gir altså lettest fra seg elektroner av disse tre, og er minst elektronegativ.
Next
elektronegativitet

Det høyrer til og dermed i. Vid en reaktion mellan en alkalimetall och en halogen förskjuts alkalimetallens valenselektron till halogenens varvid båda får ädelgasstruktur. Precis som hos enkla kovalenta bindningar, s. Föreningen mellan två väteatomer blir alltså mer stabil än de två väteatomerna var för sig. Eftersom koldioxidmolekylen är rak hamnar medelvärdet för de två negativt laddade partiklarna i exakt samma punkt som den positiva laddningen. När de reagerar med varandra bildar de därför metallkristaller som består av positivt laddade joner.
Next
Naturfagblogg : Enkle redoksreaksjoner

En elektronövergång har skett och två joner bildats: Positivt laddade natriumjoner, Na +, och negativt laddade kloridjoner, Cl -. En metall kan därför smidas och valsas utan att metallen spricker. Metallene har få elektroner i det ytterste skallet, og har lett for å gi disse fra seg til grunnstoffer i gruppe 16 og 17, i et ønske om å oppnå edelgasstruktur. Många egenskaper hos ett ämne med en viss typ av kemisk bindning är alltså karaktäristiska även för andra ämnen som har samma typ av bindning trots att de är uppbyggda av olika atomslag. Utarma uran inneheld i hovudsak den minst radioaktive isotopen 238U, men også små mengder av meir radioaktivt material. Även deras kemiska bindning, dvs de krafter som gör att atomerna hålls samman, kan göra att även ämnen som består av likadana atomer kan få fullständigt olika egenskaper.
Next
Elektrokemiska spänningsserien

Motivering: se diskussion 2011-03 Åtgärda genom att lägga till. En kristall är alltså en fast, tredimensionell struktur uppbyggd av joner som hålls samman genom jonbindning. Kobbertråden skjedde det derimot ingenting med, uansett hvor lenge vi ventet. I en kovalent bindning är elektronmolnet gemensamt för båda atomerna, i en jonbindning tangerar bara de två separata elektronmolnen varandra. Fluor F er det mest elektronegative grunnstoffet. Detta beror på den starka bindningen mellan molekylerna i fast och flytande väteflourid, vatten och ammoniak. Deretter ser vi på 4 bestemte halider og bruker nomenklatur-regler for å navnsette.
Next








