Entartete orbitale. Entartetes Orbital bei der Molekülorbital 2019-11-28
inorganic
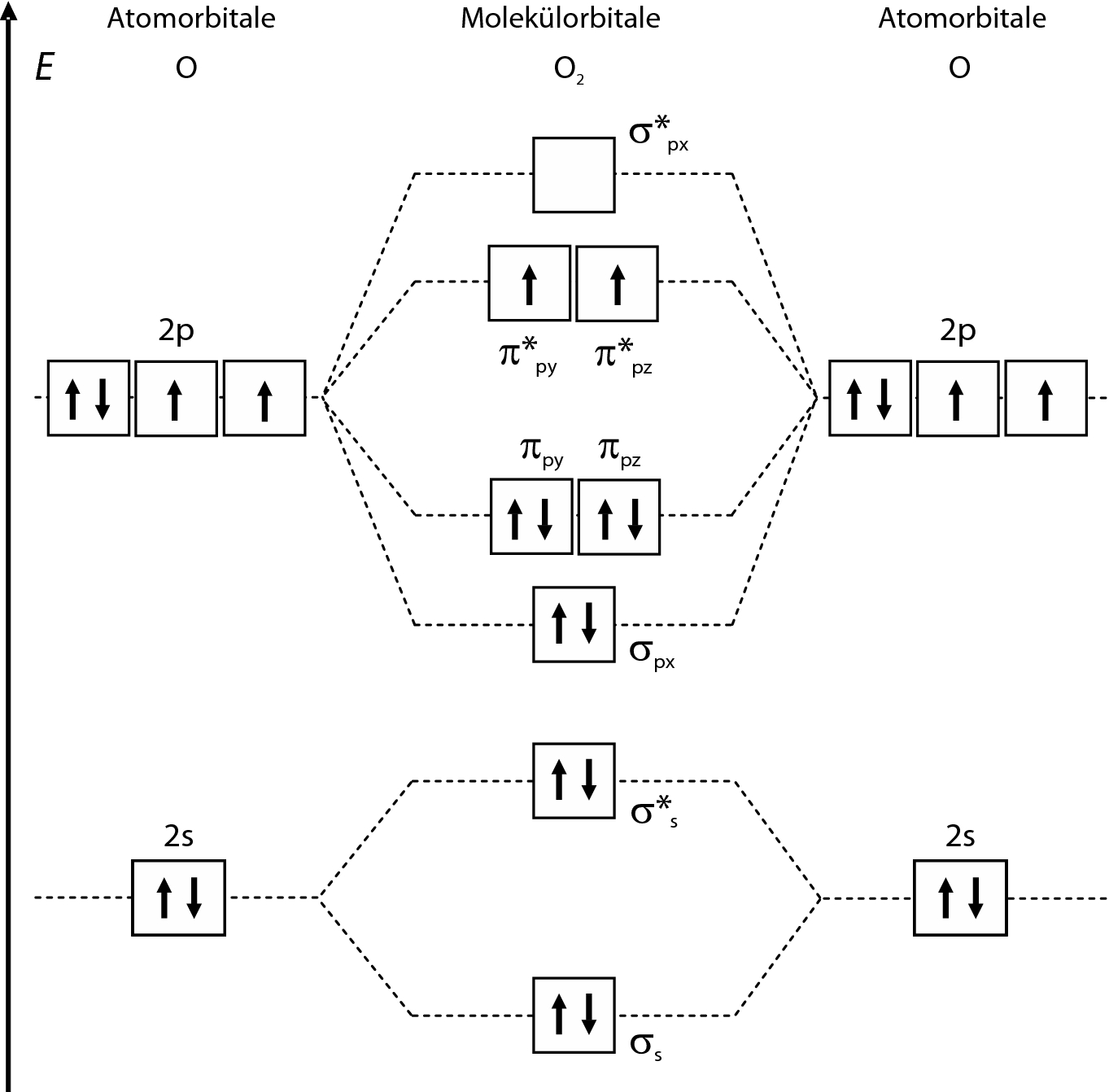
Vier sp 3-Orbitale richten sich tetraedrisch aus. Wird die z-Achse als C-O-Bindungsrichtung gewählt, so stehen je zwei p x- und p y-Orbitale so einander gegenüber, dass zwei entartete bindende und zwei entartete antibindende π-Orbitale entstehen gestrichelte Linien in der Abbildung. Werden aber die Orbitalenergien und die Beiträge der einzelnen Atomorbitale zu den Molekülorbitalen durch quantenchemische Rechnungen ermittelt, so gelingt es, das Schema plausibel zu interpretieren. Informationen zu den Urhebern und zum Lizenzstatus eingebundener Mediendateien etwa Bilder oder Videos können im Regelfall durch Anklicken dieser abgerufen werden. Hinweis: Die Anzahl der Elektronen und Protonen sind bei den Elementen gleich. Mnemosynes Senior Member Anmeldungsdatum: 31.
Next
Einführung ins Orbitalmodell 3: Pauli
Ausser wenn es wirklich mal wieder dicke kommt. Die folgenden Grafiken verdeutlichen dies besser als Text. Du kannst deine Beiträge in diesem Forum nicht bearbeiten. Alle Kombinationen n 1, n 2 und n 3, die den gleichen Wert für K ergeben, haben die gleiche Energie. Vielleicht helfen dir diese Stichworte weiter? Die elektrostatische Abstoßungsenergie ist deshalb im ersten Fall größer als im zweiten. Wie unterscheiden sich verschiedene Orbitale? Dieses Phänomen wird als Heisenbergsche Unschärferelation bezeichnet und wurde vom Nobelpreisträger Werner Karl Heisenberg aufgestellt.
Next
Entartung (Quantenmechanik)

Sie werden als Hybridorbitale bezeichnet. Für das Orbitalmodell werden vier Quantenzahlen ausgegeben, die wir im nun Folgenden betrachten möchten. Das bedeutet, dass die Hybridorbitale wieder eine bilden müssen. Für die Schlussfolgerungen ist das kein Problem, solange die entsprechenden Wellenfunktionen orthogonal sind. Quantentheorie Aus der nichtrelativistischen ergeben sich die Orbitale nach folgender Rechnung: Die Wechselwirkung zwischen Elektron und Atomkern wird vereinfacht durch das beschrieben, der Atomkern wird als fix angenommen.
Next
Aufbauprinzip des Periodensystems

Die vom Mittelpunkt aus gemessenen Winkel sind gleich. Tatsächlich jedoch sind die vier Bindungen gleichartig und nicht unterscheidbar. Bent: An Appraisal of Valence-bond Structures and Hybridization in Compounds of the First-row elements. So ist es auch mit dem Elektron: Man weißt recht gut in welchem Bereich es sein muss, jedoch die wirklich genaue Position ist nicht zu erkennen. Zum Verständnis: Die Orbitale sind die Plätze, die Elektronen zur Verfügung stehen. } Das bedeutet, dass die Untermöglichkeiten zu n und l als Zustände gleicher Energie behandelt werden; die Orbitale p x, p y und p z haben damit die gleiche Energie. Die Anzahl der Unterschalen ist gleich der Hauptquantenzahl.
Next
Entartung_(Quantenmechanik)
In der dritten Schale beginnt dieser Prozess mit aufsteigender Elektronenzahl von vorne. Besetzung von Orbitalen: Besetzungsregeln Für die Besetzung der mit im Grundzustand gibt es drei wichtige Regeln: Energie-Prinzip Die freien werden in der energetischen Reihenfolge aufgefüllt, d. Soviel sei jedoch gesagt: Die nachfolgenden 8 Elemente Lithium bis Neon besitzen Elektronen in der zweiten Schale. August 2012 : Allgemeine Chemie. Ein weiteres Merkmal der Wellenfunktion ψ n1,n2.
Next
Entartung und Symmetrie

Soll ein ganzer Satz von Hybridorbitalen gebildet werden, ist zu beachten, dass die Transformationsmatrix eine reeller Spezialfall: sein muss. Korrekturen aufgrund der Wechselwirkung mit dem und aufgrund der reduzieren die Entartung weiter, bis auf die Entartung in den Komponenten des Gesamtdrehimpulses, die wegen der Rotationssymmetrie erhalten bleibt. Du kannst an Umfragen in diesem Forum nicht mitmachen. Nur halt, dass sie in der Nähe der Lampe ist. Vielmehr brachten Entwicklungen der die Erkenntnis, dass der genaue Aufenthaltsort der Elektronen aufgrund der Werner Heisenbergs nicht exakt, sondern nur ihre Verteilung stochastisch beschrieben werden kann. . Du kannst auf Beiträge in diesem Forum nicht antworten.
Next
Orbitalbesetzung
Von Interesse ist, wie wir ausgehend von Wasserstoff mit steigender Elektronenzahl schrittweise die Besetzung der Orbitale mit Elektronen erklären können. Die Artikel und überschneiden sich thematisch. Die Anzahl der Orbitale pro Unterschale ist auf 2l + 1 begrenzt. . Die Zustände sind durch die drei zugehörigen Quantenzahlen n, l und m bestimmt. Charakteristische Formen Die Orbitale zu den verschiedenen l Zahlen haben charakteristische grobe Formen, die auch bei höheren n-Werten qualitativ erhalten bleiben.
Next
inorganic

Beteilige dich dazu an der. Im nun Folgenden soll dabei auf die Grundgedanken des Orbitalmodells eingegangen werden. Da mir dann mehr als ein mögliches Thema präsentiert wurde wäre es auch für mich interessant gewesen, worum es sich denn nun eigentlich handelt. Und das Beste: TheSimpleClub ist und bleibt komplett kostenlos! Entartung ist in vielen Fällen Folge einer des physikalischen Systems. Dies soll nun anhand von einigen Beispielen noch einleuchtender werden. Es entspricht gewissermaßen der Schale n des.
Next







