Estructura de lewis de h3po4. Ácido fosfórico (H3PO4): estructura, propiedades, usos 2019-11-17
Ca3(PO4)2 estructura de lewis

Al reaccionar con estos metales se origina el gas combustible hidrógeno. Ácidos polifosfóricos La deshidratación puede proseguir con el ácido pirofosfórico si el calentamiento continúa. En general, me gusta comparar la funcionalidad de una estructura molecular no sólo con elementos dinámicos, como las máquinas, sino también con una catedral, o un campanario. Sufrió debilidad general, tos seca, dolor torácico y problemas respiratorios. Ácido fosfórico — Efectos en la Salud. Auto ignición No es inflamable. Amante y aprendiz de las letras.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos
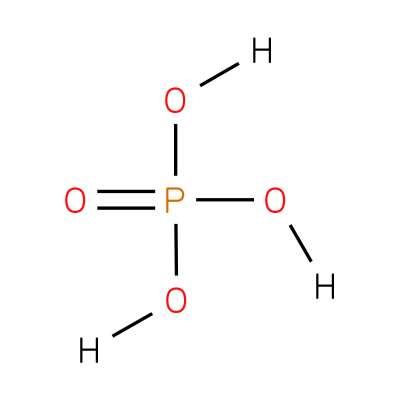
Cada una con sus distintos grados de protonación del anión fosfato. Viscosidad 3,86 mPoise solución al 40% a 20º C. Debido a la presencia de ellos en su estructura, puede reaccionar con diferentes originando varias sales. En la imagen superior se muestra una molécula individual del ácido fosfórico. Es usado como un agente oxidante químico para la producción de carbón activado.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos

H Padleckas assumed based on copyright claims. . Polimerización Polimeriza violentamente con compuestos azo, epóxidos y compuestos polimerizables. Piro El prefijo piro se refiere a todo compuesto originado tras la aplicación de calor, ya que el ácido difosfórico surge a partir de la deshidratación térmica del ácido fosfórico. Structure of Crystalline Phosphoric Acid. Este tipo de reacción hace que este compuesto sea capaz de establecer un gran número de estructuras con esqueletos de fósforo y oxígeno, de las cuales también pueden obtenerse una amplia gama de sales conocidas como los polifosfatos. Este sistema regulador del pH está presente en el hombre, teniendo importancia en la regulación del pH intracelular, así como en el manejo de la concentración de hidrógeno en los túbulos distal y colector de las nefronas.
Next
Ca3(PO4)2 estructura de lewis

Asimismo encuentra uso en el blanqueamiento dental y en la eliminación de las placas dentales. Asimismo actúa como sistema amortiguador en la preparación del jamón, la gelatina y los antibióticos. Además, se utiliza en la fabricación de pegamentos para las prótesis dentales. Bajo la forma líquida es cristalino de aspecto de un jarabe viscoso. El fósforo, junto con el potasio y el nitrógeno constituyen los tres principales nutrientes de las plantas. Basta con sustituir los H por R en todas las estructuras de la imagen del apartado para obtenerlos. Su forma anhidra también puede describirse con la fórmula: 3H 2O·P 2O 5, lo que es igual a un pentóxido de fósforo tri-hidratado.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos

Dicha densidad viene de la mano de la concentración. Ácidos polifosfóricos cíclicos Las cadenas P—O—P pueden incluso cerrarse en un anillo o ciclo fosfórico. Debido a esto, el H 4P 2O 7 presenta cuatro constantes de ionización k a. Además, se utiliza en la determinación de carbón orgánico en suelos. En todas estas presentaciones carece de olor. Cosméticos El ácido fosfórico es usado para ajustar el pH en la elaboración de productos cosméticos y para el cuidado de la piel.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos

Con el átomo de fósforo situándose en el centro, los oxígenos dibujan una especie de tetraedro molecular. Corrosividad Corrosivo a metales ferrosos y aluminio. Así, se le adjudica el prefijo orto a aquellos ácidos formados con abundante agua. Se le llama por lo tanto ácido pirofosfórico 2H 2O·P 2O 5. Usos Sales de fosfatos y usos generales -El ácido fosfórico sirve de base para elaboración de fosfatos, los cuales se emplean como fertilizantes debido a que el fósforo es un nutriente principal de las plantas. También se utiliza en el pulido eléctrico del aluminio y es un agente enlazante de productos refractarios como la alúmina y la magnesia. Orto Sin embargo, al ácido fosfórico también se le dice comúnmente ácido ortofosfórico.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos
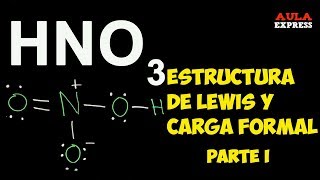
No obstante, dependiendo de cuál base se utilice para su neutralización, o qué cationes estén muy cerca de él, puede formar otras sales de fosfatos. By No machine-readable author provided. Puede observarse cómo el esqueleto P—O—P se alarga en una especie de cadena conformada por tetraedros. Industriales -El ácido fosfórico es destinado como agente catalítico en la elaboración del Nylon y la gasolina. Si la temperatura se eleva a 213º C o más se convierte en ácido pirofosfórico H 4P 2O 7. Se usa como agente deshidratante en el grabado litográfico, en la elaboración de tintes para su uso en la industria textil, en el proceso de coagulación del látex en la industria cauchera y en la purificación del peróxido de hidrógeno.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos

Odontológicos Es usado por los odontólogos para limpiar y acondicionar la superficie dental antes de la colocación de los soportes dentales. Ácido fosfórico » Variedad De Usos De Este Compuesto Químico. Dos unidades se unen covalentemente al eliminarse una molécula de agua, formándose un puente de oxígeno P—O—P entre ellas. Al cabo de un año de la exposición, se observó una disfunción reactiva de las vías respiratorias. La industria farmacéutica lo utiliza en la fabricación de medicamentos antieméticos.
Next
Ácido fosfórico (H3PO4): estructura, propiedades, usos
Respecto a su descubrimiento, fue sintetizado en 1694 por Robert Boyle, disolviendo P 2O 5 pentóxido de fósforo en agua. Los tetraedros pueden llegar incluso a enlazarse covalentemente, pero para ello una de sus unidades debe eliminar una molécula de agua mediante la deshidratación. Siento enorme interés por la química supramolecular, la nanotecnología, y los compuestos organometálicos. Cuando estos compuestos se neutralizan con una base completamente, se origina los llamados polifosfatos. Descomposición Al calentarse libera óxidos de fósforo. En la imagen del apartado se ilustran en la esquina superior izquierda las estructuras del ácido ortofosfórico y del pirofosfórico.
Next







