Hva er et grunnstoff. atom 2019-12-09
Hva er et Grunnstoff? Les informasjon om Grunnstoff
I tabellen under vises noen av de mest vanlige grunnstoffene og forekomsten deres tabellen er sortérbar. Dette skyldes at atommassen for et grunnstoff er den midlere gjennomsnittlige massen av de naturlig forekommende isotopene, når disse blir vektet ut fra hvor vanlige de er. Grunnstoffer kan være gass, i fast form, eller flytende. Bildet av periodesystemet er produsert av Store norske leksikon og kan lastes ned. For å lage dette, måtte forskerne ha et annet grunnstoff, berkelium. Strømmer det ut på overflaten, kalles det lava. De er omtrent like tunge.
Next
Hva er et grunnstoff? by Øystein Felle on Prezi
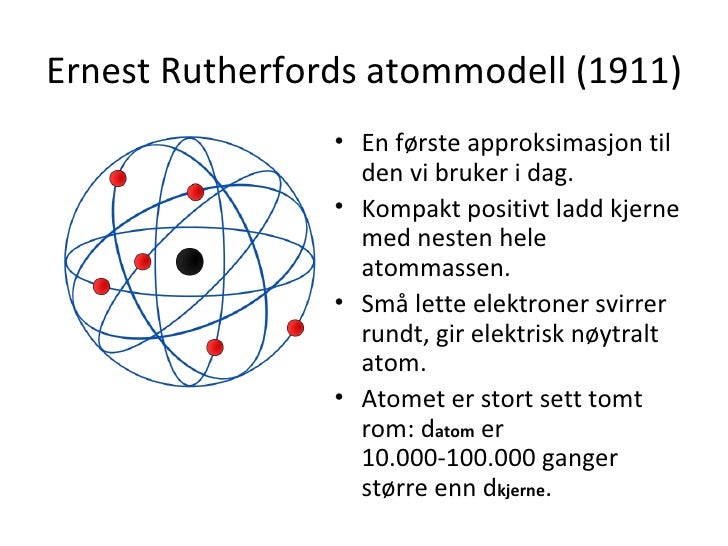
Første periode inneholder bare hydrogen og helium. Atomkjernen er bygd opp av disse. Nukleon: er en fellesbetegnelse på nøytron og proton. Problemet var at bokstavene var brukt forskjellig, noe som gjorde at misforståelser lett kunne oppstå se tabell under. Slike proteiner er blant annet nødvendige for å danne skjelett, organer, bindevev, muskler, hud og hår. Denne tabellen viste ikke bare det kjemiske slektskapet mellom de forskjellige grunnstoffene, men kunne også forutsi både eksistensen av — og egenskapene til grunnstoff som til da ikke var oppdaget.
Next
Hva er ditt favoritt

Alkalimetallenes rake motsetning er som utgjør gruppe 18. Slike batterier erstattes nå etter hvert med andre energikilder, f. Og gull er satt sammen av bare gull-atomer. Isotoper Isotopene har like mange protoner atomnummeret , men forskjellig antall nøytroner, og får derfor et annet massenummer. Reduksjon: atomer tar opp ett eller flere elektroner, og blir negativt ladet på grunn av forholdet mellom elektronene og kjernepartiklenene.
Next
Periodesystemet

Elektroner med samme energi kan sies å være i samme. Det regnes som sannsynlig at metoden etter hvert vil fortrenge diffusjonsmetodene som til nå har vært mest brukt. Unntaket var som Mendelejev ikke hadde forutsett og satt av plass til. Det er rundt en million forskjellige proteiner i menneskekroppen, og mange flere i andre arter. . Soddy foreslo i 1913 betegnelsen isotop på slike atomer med samme kjemiske, men forskjellige fysiske egenskaper. Et grunnstoff er en type stoff som ikke kan deles opp i flere deler.
Next
ahintz.com: Grunnstoff og andre begreper i undervisningen

Og atomene er bygget opp av enda mindre biter. Derimot kan de ulike energitilstandene til atomet bestemmes ut i fra fargene på lyset atomet kan sende ut og absorbere. Ved gassdiffusjon gjennom en porøs skillevegg vil lette isotoper diffundere raskere enn tunge, fordi de molekylene som inneholder den letteste isotopen i middel har større termisk hastighet enn de som inneholder den tyngste isotopen. Atomnummeret er det samme som antallet protoner i kjernen, og er det som bestemmer hvilket grunnstoff det er. Den første var den tyske kjemiker som ordnet grunnstoffer med like kjemiske egenskaper i triader: klor, brom, jod , svovel, selen, tellur og kalsium, strontium, barium.
Next
Hva er forskjellen mellom et atom og et grunnstoff?

De øvrige gruppene fra og med 3 til og med 12 ble tidligere kalt bigrupper, og grunnstoffene ble kalt innskuddsgrunnstoffer. For framtidens mulige fusjonsreaktorer der hydrogenatomer smelter sammen til helium kjerner utvikles det ekstra mye energi. Også syvende periode med actinoidene inneholder 32 grunnstoffer. Lavoisier satte opp den første tabell over 33 stoffer som han mente var grunnstoffer i 1789. Slike radioaktive isotoper av et grunnstoff har alle forskjellige radioaktive egenskaper.
Next
Periodesystemet
Det er gratis å lese alle artiklene på snl. Atomer kan ha opptil tre bindinger. Noen av de kjemiske seriene sammenfaller med periodesystemets grupper, mens andre spenner over flere grupper. I videoen forteller forskeren Nick Lane om sitt favoritt-grunnstoff. Spor av atomnummer 93 og atomnummer 94 finnes i uranmalm, men disse er resultat av av uran, og defineres ikke som naturlige forekomster. Han utviklet også et notasjonssystem der grunnstoffenes navn ble erstattet av bokstavforkortelser — et system som fortsatt er i bruk.
Next
periodesystemet

I dette tilfellet dannes det negativt ladde , og ladningen deres svarer til det antallet elektroner atomet har tatt opp. Andre proteiner utfører spesielle oppgaver i og mellom cellene. Selve forskjellen ligger, som Loev sier, i antallet protoner i atomkjernen. På 1860-tallet var antallet oppdagede grunnstoff kommet opp i over 60, og det syntes som det ikke var noen grense for hvor mange kjemiske forbindelser som fantes. Gasstrålen deles slik at den sentrale strålen som inneholder den tunge isotopen, går én vei og randstrålen, som er anriket på den lette isotopen, ledes en annen vei.
Next





