Struktur lewis hno3. The Lewis structure of HNO3 2020-01-14
gambarkan rumus titik elektron (struktur lewis) dari molekul yang ada di bawah ini Cl2o,NCl3,P2O3

It is also common to write a mixture of resonance structures as the hybrid form Note that this representation is not a single Lewis structure, but a convenient way to represent many resonance structures in the same figure. Over here, you have a +1 on the Nitrogen and then you have a -1 on the Oxygen, a -1, and then a +1 on this Oxygen. Dalam rumus kerangka, atom karbon tidak ditandai oleh simbol C tetapi oleh garis. One question you might ask is, why didn't we put a double bond right here on this Oxygen instead of putting it over here? Kation dan Anion Rumus Senyawa Reaksi Kimia 1. Struktur Lewis juga dikenal sebagai diagram titik Lewis, rumus titik Lewis, struktur titik Lewis, dan struktur titik elektron adalah diagram yang menunjukkan antara suatu dengan yang mungkin ada dalam molekul. When we calculate our formal charges, this Oxygen up here will have a negative 1 and the Nitrogen will have a positive 1.
Next
Kumpulan Struktur Lewis berbagai Senyawa

It can hold up to 18 electrons. Arrhenius menemukan bahwa zat elektrolit dalam air akan terurai menjadi partikel-partikel berupa atom atau gugus atom yang bermuatan listrik. Ikatan tunggal juga dapat dipindahkan dengan cara yang sama untuk menciptakan struktur resonansi untuk seperti , yang merupakan deskripsi yang benar menurut perhitungan kimia kuantum, bukan model oktet umum yang diperluas. Over here, you have a +1 on the Nitrogen and then you have a -1 on the Oxygen, a -1, and then a +1 on this Oxygen. Over here you have a +1 on the Nitrogen and then a -1 on the Oxygen.
Next
Lewis Structure for HNO3

Here, the pink atom is the Oxygen, and the white molecules are. So we've used all 24 valence electrons. Nitrogen atom has no d orbital because it is the in second period. It gives no information about the exact bond order or formal charges on individual atoms. Pembuktian sifat larutan elektrolit yang dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen.
Next
HNO3 Lewis Structure

Karenanya, perkaratan korosi tingkat berat bisa terjadi. By doing that, Nitrogen now has 8; this Oxygen right here, it has 8; and we've still used only 24 valence electrons. As a result, we usually only write the two dominant structures. Kation dan anion yang dibentuk akan sangat berguna ketika unsur tersebut berikatan dengan unsur yang lain membentuk senyawa. In this case the formal charges will be closer to zero if you place a double bond beteween the Nitrogen atom and the Oxygen atom without the H attached.
Next
Lewis structure for HNO3

It looks like all the oxygen atoms are single bonded in the figure to the top right. As a comparison, first shell atoms obey the duet rule while atoms in the 3rd shell and beyond may obey 18-electron rule, 12-electron rule or 8-electron rule. Itulah sebabnya larutan non elektrolit tidak dapat menghantarkan listrik. Dalam larutan, mereka tetap berupa molekul yang tidak bermuatan listrik. Right Oxygen: It free-loads on Nitrogen, bonding to Nitrogen's 2 electrons in the single bond.
Next
Nitric acid
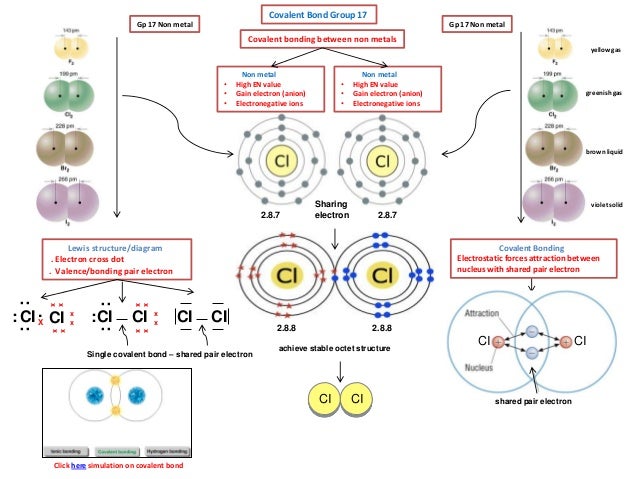
Kemudian ditentukan pasangan elektron yang dipakai untuk berikatan dengan berpedoman bahwa elektron stabil harus sesuai aturan oktet. Unsur-unsur yang kekurangan elektron akan saling menyumbangkan elektronnya untuk digunakan berikatan satu sama lain. One question you might ask is, why didn't we put a double bond right here on this Oxygen instead of putting it over here? In order to determine the molecular geometry for H2O, observe the Lewis structure of the same. Oleh karena pasangan ikatan dibagi antara dua atom, atom yang semula memiliki pasangan sunyi masih memiliki oktet; atom lainnya sekarang memiliki dua elektron lagi di dalam kelopak valensinya. Ketika menulis struktur Lewis sebuah ion, keseluruhan struktur ditempatkan dalam tanda kurung, dan muatannya ditulis sebagai superskrip di kanan atas, di luar tanda kurung. Iwan Ostromisslensky had no problems drawing 4-chloro-1,2-dinitrobenzene with a pentavalent nitrogen in 1908. The dotted lines indicates that in some structures where that bond is a single bond and in others a double bond, and the order is somewhere between 1 and 2.
Next
Asam nitrat

Ion yang bemuatan positif disebut kation, sedangkan ion yang bermuatan negatif disebut anion. One of the oxygen binds with an atom of hydrogen and share an electron with nitrogen to complete its octet and the remaining oxygen atom share an other electron with nitrogen atom. Ketika membandingkan struktur resonansi untuk molekul yang sama, biasanya yang memiliki muatan formal paling sedikit adalah yang berkontribusi lebih banyak terhadap hibrida resonansi keseluruhan. Larutan non elektrolit tidak dapat menghantarkan listrik. Dengan cara ini dimungkinkan untuk memahami ikatan kimia yang membentuk molekul hidrogen. Jika ada elektron dari atom pusat yang tidak dipakai untuk berikatan disebut pasangan elektron bebas. Atom hidrogen yang terikat pada karbon tidak diperlihatkan—mereka dapat disimpulkan dengan menghitung jumlah ikatan pada atom karbon tertentu—masing-masing karbon diasumsikan memiliki total empat ikatan, sehingga setiap ikatan yang tidak ditunjukkan adalah atom hidrogen.
Next
Struktur Lewis
Proses pelarutan padatan kristal 3. There is also an easy way available. Zat-zat yang tergolong elektrolit yaitu asam, basa, dan garam. Lambang Lewis dibuat dengan cara menuliskan lambang atom dikelilingi oleh sejumlah titik atau garis untuk menyatakan atom valensi. Elektron dalam ikatan kovalen dibagi rata antara atom yang terlibat dalam ikatan.
Next






